Sanitat informa de la suspensió temporal de la comercialització de l’implant anticonceptiu Essure
"No escau aconsellar la retirada del dispositiu ni modificar les pautes de seguiment de les persones que en són portadores", diu l'Agència Espanyola de Medicaments i Productes Sanitaris
El laboratori farmacèutic Bayer Hispania ha informat l'Agència Espanyola de Medicaments i Productes Sanitaris (AEMPS) de la retirada temporal del mercat de l'implant anticonceptiu Essure. En un comunicat, l'AEMPS informa que "no escau aconsellar la retirada del dispositiu ni modificar les pautes de seguiment" de les qui ja tinguin aquest sistema implantat, però recomana a les dones que experimentin alguna simptomatologia que consultin amb el seu metge.
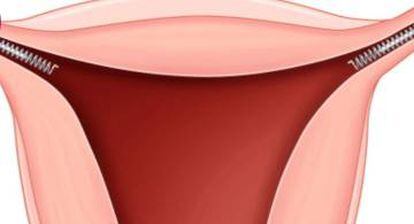
Essure és un sistema anticonceptiu permanent amb forma de molla. S'implanta a les trompes de Fal·lopi i al cap de tres mesos es genera un teixit que l'embolcalla i que bloqueja el conducte pel qual els òvuls viatgen des de l'ovari fins a l'úter.
Grups de pacients han presentat queixes davant les autoritats a diferents països on es comercialitza Essure. A Espanya estan organitzades en una associació que informa de les seves activitats a través de la pàgina a Facebook Problemas con Essure. Entre els possibles efectes secundaris que citen derivats de l'implant hi ha la perforació de l'úter o de les trompes de Fal·lopi.
Als Estats Units la quantitat de queixes rebudes va portar a la Food and Drug Administration, l'equivalent de l'AEMPS espanyola, a estudiar amb detall aquest implant el 2015. El febrer del 2016 l'agència va ordenar a Bayer que corregís els advertiments perquè les pacients estiguessin ben informades dels riscos i que s'hi inclogués un missatge d'avís semblant al que es fa servir als paquets de tabac. També va demanar als metges que fessin seguiment de les seves pacients després d'implantar-los Essure i a Bayer li va ordenar que fes un estudi sobre la seva utilització i els efectes secundaris que es produeixen després d'implantar-se.
Suspensió del certificat CE
La suspensió de l'ús i la comercialització a Espanya i a altres països de la UE es deu al fet que l'organisme irlandès NSAI ha demanat informació complementària a la farmacèutica Bayer abans de renovar-li el certificat CE. Aquest certificat indica que es compleixen els requisits essencials de seguretat, eficàcia i qualitat que estableix la regulació europea.
La suspensió del certificat té efectes des del 3 d'agost del 2017 i per un període de 90 dies, fins al 2 de novembre del 2017, segons l'AEMPS. Mentre aquesta suspensió estigui en vigor, el producte no s'ha de comercialitzar.
"Igualment, com a mesura de precaució, els centres i professionals sanitaris que disposin d'Essure han de parar d'utilitzar-lo", diu l'AEMPS, que recomana a les dones que tinguin previst implantar-se'l que s'informin dels "mètodes de contracepció disponibles més adequats i els seus eventuals efectes indesitjables".
L'agència espanyola, que depèn del Ministeri de Sanitat, intenta tranquil·litzar les usuàries citant un estudi epidemiològic francès del 2017 fet amb més de 100.000 dones que "no qüestionen la relació benefici/risc de l'implant". Per aquesta raó, diu, "no escau aconsellar la retirada del dispositiu ni modificar les pautes de seguiment de les persones que en són portadores", però recomana a les pacients que tinguin algun símptoma que consultin amb el metge.